2017年7月7日���,生掷中心董晨研究组在《Cell Research》杂志在线揭晓题为“Inhibition of the B7-H3 immune checkpoint limitstumor growth by enhancing cytotoxic lymphocyte function”的研究论文���,展现了免疫检查点B7-H3在抗肿瘤免疫反应中的负调控作用、其作用机制及其潜在的临床应用远景�����。
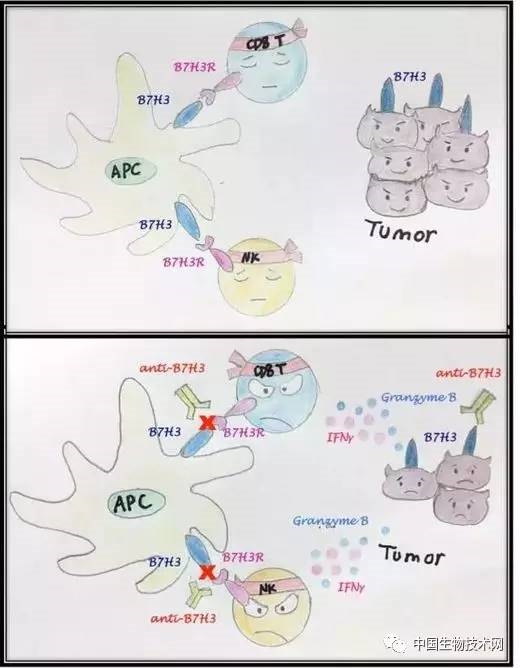
人体内的免疫效应细胞(如CD8+ T淋巴细胞和NK细胞——自然杀伤细胞)可以识别并杀伤癌细胞���,但它们的杀伤功效往往被它们激活后上调的免疫检查点分子(如PD-1、CTLA-4和Tim-3)所抑制�����。拮抗免疫检查点的药物(如PD-1、CTLA-4中和抗体)在多种癌症的临床试验中有突出的疗效并已获美国FDA批准用于玄色素瘤、非小细胞肺癌等疾病的治疗�����。但只有一小部分的病人在用药后可以爆发较好的应答���,另外一大部分病人在短暂应答之后癌症继续恶化���,这提醒我们可能尚有其它免疫检查点分子加入抵御免疫杀伤���,也可以作为肿瘤免疫治疗或团结治疗的药物靶点�����。B7-H3是B7卵白家族的一员���,与PD-L1(PD-1的配体)有28%的序列同源性���,董晨等研究组之前研究批注B7-H3调控T细胞活化���,它在肿瘤组织中的表达与疾病希望和预后相关�����。然而���,B7-H3在抗肿瘤免疫应答中的功效和作用机制尚未研究清晰���,B7-H3的受体也未确定�����。
董晨研究组发明B7-H3在人类肿瘤都普遍高表达���,并在肿瘤病人(玄色素瘤、肝癌)和荷瘤小鼠中检测B7-H3及其受体的表达�����。B7-H3高表达于肿瘤组织中的抗原呈递细胞(如巨噬细胞、树突状细胞)和肿瘤细胞外貌���,而它的受体则主要在CD8+ T和NK细胞上表达���,说明肿瘤微情形中B7-H3及其受体的相互作用有可能抑制抗肿瘤免疫效应细胞的功效�����。接着���,他们在多个小鼠肿瘤模子中探讨敲除B7-H3基因或注射B7-H3中和抗体对肿瘤生长的影响�����。当B7-H3信号通路被抑制时���,皮下注射的E.G7、A20淋巴瘤、MOPC315骨髓瘤的生长减缓���,静脉注射的B16玄色素瘤的肺转移癌灶也镌汰���,并且这种抑制肿瘤的效应依赖于CD8+ T和NK细胞�����。
于是���,董晨研究组进一步探讨B7-H3怎样影响肿瘤微情形中CD8+ T和NK细胞的功效�����。虽然在B7-H3敲除小鼠(E.G7模子)中肿瘤浸润的CD8+ T的比例没有转变���,但肿瘤抗原(OVA)特异性CD8+ T细胞的比例上升�;同时���,B7-H3敲除小鼠肿瘤中的CD8+ T细胞渗透gamma滋扰素和颗粒酶B等杀伤肿瘤的效应分子增多���,批注B7-H3抑制抗肿瘤CD8+ T细胞的增殖和效应功效�����。另外���,B7-H3敲除小鼠(E.G7及B6-F10模子)中NK细胞的数目和杀伤功效显著上调�;与缺失B7-H3的树突状细胞共作育的NK细胞对靶细胞具有更强的杀伤效应�;体外ADCC实验批注���,B7-H3卵白可直接作用于人NK细胞来抑制其去颗粒历程�����。
由于抑制B7-H3信号后肿瘤中的CD8+ T和NK细胞外貌的PD-1上调���,并且E.G7荷瘤小鼠的肿瘤组织中同时表达B7-H3和PD-L1���,董晨研究组进一步探讨抗B7-H3和PD-1中和抗体联适用药的可能性�����。在E.G7小鼠模子中���,注射肿瘤7天后B7-H3抗体和PD-1抗体的团结治疗相比于单独治疗可以更好地抑制肿瘤生长�;但若是在肿瘤生长早期(第三天)就最先注射抗体则视察不到协同作用�����。他们的研究批注���,B7-H3抗体与PD-1抗体的联适用药有望进一步改善现在用于临床的PD-1抗体治疗的疗效���,尤其是关于晚期肿瘤�����。
董晨教授为本文的通讯作者���,董晨研究组前博士后Young-hee Lee和Natalia Martin-Orozco为本文的配合第一作者���,论文的其它作者还包括来自清华大学、美国安德森癌症研究中心、美国国立儿童医院、多伦多大学和苏州鑫康合公司等多个单位的研究者�����。