自上个世纪下叶被发明以来�,紫杉醇(Paclitaxel�,PTX)就一直是化疗界的明星��。由于其高度抗癌活性�,紫杉醇现在已经被普遍应用于卵巢癌、乳腺癌、肺癌等多种癌症的一线治疗[1]��。奇点糕还记得一经有过新闻�,紫杉醇的质料红豆杉被黎民剥了树皮泡酒�,引为抗癌“神药”(虽然了�,这是个过失的做法�,直接服用红豆杉可是会中毒的)��。
不过�,紫杉醇的作用也是把双刃剑�,在使用细胞毒性杀死癌细胞的同时�,它也会增添癌细胞对化疗剂的抗性并增进癌细胞转移��。在8月份的《美国国家科学院院刊》(PNAS)上�,来自俄亥俄州立大学生物化学与药理学教授Tsonwin Hai团队的一项研究为紫杉醇增进乳腺癌的肺转移[2]提供了“实锤”��。

Tsonwin Hai教授
研究效果展现了两个主要的机制:一是紫杉醇会改变原发肿瘤周边血管的状态�,资助乳腺癌细胞进入血循环����;二是它还会在肺组织中“辛勤耕作”�,使肺组织微情形更适合癌细胞生涯�,增进癌细胞“生根抽芽”��。而这些有害影响�,都要通过一个名为Atf3的基因来实现��。
Atf3是一种应激快反应基因�,正常情形下表达量很是低�,当受到外界信号刺激�,就会快速大宗表达��。表达产品Atf3卵白是一种转录因子�,能够直接或间接调控许多加入炎症反应的基因的表达[3]��。
那么事实科学家是怎么证实紫杉醇的“叛变”行为的呢����?
Hai教授和她的团队在小鼠身上举行了试验��。他们对能够爆发自觉转移的乳腺癌模子小鼠注射了一定量的紫杉醇��。比起比照组�,注射了紫杉醇的实验组小鼠原发肿瘤确实有缩小�,可是转移到肺部的癌细胞却更多!研究者对敲除了Atf3基因的小鼠也做了同样的实验�,效果却并没有什么差别��。这足以说明紫杉醇的这种增进癌症转移的作用与Atf3基因有关了��。
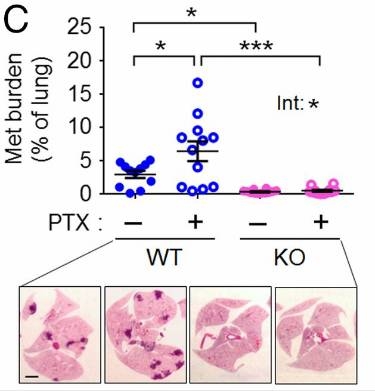
上:在第26天�,不使用紫杉醇治疗和使用紫杉醇治疗以及敲除Atf3基因后不使用紫杉醇治疗和使用紫杉醇治疗的四种小鼠肺转移肿瘤占总肺部的面积
下:四种小鼠的肺部切片�,深色部分为转移瘤
为了搞扫除紫杉醇和Atf3基因究竟是怎么使坏的�,研究职员对这几种肿瘤组织举行了检测�,发明用紫杉醇治疗的小鼠肿瘤组织中微血管的密度特殊高�,并且一些能资助肿瘤转移和新血管天生的细胞(表达Tie2基因的单核巨噬细胞�,TEMs)也增添了��。他们还发明�,和血管天生有关的一些基因表达量高(如Ang1�,Notch1和Cxcl1)�,和抗血管天生有关的一些基因表达量低(如Cxcl9、10、11和14)��。
另外�,尚有一个有意思的征象�,乳腺癌细胞扩散需要通过三种细胞的直接接触——内皮细胞、血管周围巨噬细胞和增强癌细胞扩散能力的Mena卵白水平高的癌细胞��。已往的研究发明�,这三种细胞在那里接触�,癌细胞就在那里进入血管�,厥后�,这个“位点”被命名为肿瘤转移微情形(tumor microenvironment of metastasis�,TMEM)[4]��。
以是�,TMEM就相当于一扇门�,当“三把钥匙”聚齐时�,癌细胞就可以翻开门�,进入血管中了��。在这次的研究中�,研究职员也发明�,使用紫杉醇治疗的小鼠TMEM密度显着升高�,这也说明�,紫杉醇为癌细胞多造了几扇门�,资助了它向肺部转移��。这和不久前揭晓在《科学转化医学》上的另一项研究“不约而同”�,他们在化疗的癌症患者身上也发明了这个征象[5]��。
以是这几项指标的转变意味着�,紫杉醇不但给癌细胞开拓了更多的“出走蹊径(微血管)”�,还帮它们翻开了脱离桎梏的“大门(TMEM)”��。
以上这些效果都只泛起在野生型小鼠上�,敲除了Atf3基因的小鼠实验组和比照组没有显着差别��。这说明�,紫杉醇的使用增进血管生长、增添癌细胞转移微情形�,这些影响都是通过Atf3基因实现的��。

癌细胞通过TMEM进入血管
只关注原发肿瘤还不敷�,研究职员又盯上了癌细胞转移的目的组织——肺部��。他们给用紫杉醇预处置惩罚过的小鼠静脉注射癌细胞�,最洪流平地消除了紫杉醇对癌细胞的直接杀伤影响��。
效果显示�,注射过紫杉醇的实验组肺组织比比照组有更多的癌细胞定殖��。对肺组织的检测发明�,实验组中穿孔素(Prf1)表达下调�,炎症性单核细胞(iMs)数目上升�,趋化因子配体2(CCL2)表达上调��。
Prf1是主要的溶菌卵白之一�,保存于细胞毒性T细胞和自然杀伤(NK)细胞中�,有抑癌作用[6]����;iMs可以进入肺中分解成巨噬细胞�,增进肿瘤转移[7]����;而CCL2是一种小分子卵白�,可以增进炎症性单核细胞富集�,增强炎症反应�,对肿瘤生长起着主要作用[8]��。
同样�,这些效果也只泛起在野生型小鼠上��。这说明�,紫杉醇的使用改变了肺组织的微情形�,使癌细胞更容易在肺组织上定殖�,这些影响也是通过Atf3基因实现的��。
那么现在我们可以确定了�,紫杉醇一方面促使肿瘤细胞从原发肿瘤逃离�,一方面改变肺部微情形使之更适合肿瘤细胞定殖�,而Atf3基因在其中起要害作用��。
紫杉醇(PTX)对原发肿瘤和转移组织的影响
要不是看到这些证据�,奇点糕真是不肯意信托�,紫杉醇竟然助桀为虐!不过�,这些在小鼠身上获得的实验效果�,是否适用于人类呢����?
研究者们自然也思量到了这一点��。为了证实小鼠数据与人类癌症的相关性�,他们从果真的肿瘤数据库[9]中的样本数据举行了剖析��。效果不出所料�,在接受了化疗的乳腺癌患者的肿瘤组织中�,Atf3真的有更高的表达��。响应的�,患者也泛起了高水平的CCL2、CCL7、CCL8等炎症指标以及低水平的Prf1、NK细胞和细胞毒性T细胞等��。
在乳腺癌、肺癌、卵巢癌和结肠癌中�,ATF3基因和TEK基因高表达(红)和低表达(绿)对患者生涯率的影响
这些剖析效果与小鼠试验的表征是一致的�,可见小鼠试验效果简直能展现紫杉醇在人体癌症转移中起到的作用��。
研究职员还使用其他株系的癌细胞替换了他们在这次实验中所用的乳腺癌细胞�,还实验用其他化疗药物如环磷酰胺(CTX)替换紫杉醇�,甚至还使用差别种系的小鼠举行了实验�,效果无一破例��。Atf3基因介导的化疗剂对癌症肺转移的增进作用不局限于简单化疗药物、单个癌种或单个试验工具�,这是一种在化疗中普遍保存的征象��。
鉴于早先有研究批注�,全身化疗后残留的肿瘤与临床上的不良预后有关[10]�,那么�,这个研究可以说是对以后化疗的使用很有临床意义了��。Hai教授体现�,或许未来可以通过抑制Atf3基因的表达来扫除化疗的这个副作用�,这也是他们的下一个研究目的��。
不过这个研究也保存一些局限性:对小鼠的整体研究没有步伐确定在差别类型细胞中Atf3基因的作用����;并且除了血管转移途径之外�,癌细胞也可以通过淋巴管转移�,Atf3基因对这条蹊径的影响还未可知等等��。
“研究者应当随时坚持一个坦荡的眼界��。”Hai教授在一次采访中如是说[11]��。奇点糕想�,科学或许就是在对前人的倾覆上一直前行、一直前进的吧��。
参考资料:
[1] "Paclitaxel". The American Society of Health-System Pharmacists. Retrieved January 2, 2015.
[2] Yi Seok Chang, Swati P. Jalgaonkar, Justin D. Middleton, Tsonwin Hai.Proceedings of the National Academy of Sciences, 2017; 201700455 DOI: 10.1073/pnas.1700455114.
[3] Corradini P, Ladetto M, Pileri A, Tarella C (1999) Clinical relevance of minimal residual disease monitoring in non-Hodgkin’s lymphomas: A critical reappraisal of molecular strategies. Leukemia 13:1691–1695.
[4] Harney AS, et al. (2015) Real-time imaging reveals local, transient vascular permeability, and tumor cell intravasation stimulated by TIE2hi macrophage-derived VEGFA. Cancer Discov 5:932–943.
[5] George S. Karagiannis, Jessica M. Pastoriza, Yarong Wang et al. Neoadjuvant chemotherapy induces breast cancer metastasis through a TMEM-mediated mechanism. Science Translational Medicine, 05 Jul 2017, 9(397):eaan0026, doi:10.1126/scitranslmed.aan0026.
[6] Barry M, Bleackley RC (2002) Cytotoxic T lymphocytes: All roads lead to death. Nat Rev Immunol 2:401–409.
[7] Qian BZ, et al. (2011) CCL2 recruits inflammatory monocytes to facilitate breasttumour metastasis. Nature 475:222–225.
[8] Qian B, et al. (2009) A distinct macrophage population mediates metastatic breast
cancer cell extravasation, establishment and growth. PLoS One 4:e6562.
[9] Boersma BJ, et al. (2008) A stromal gene signature associated with inflammatory breast cancer. Int J Cancer 122:1324–1332.
[10] Symmans WF, et al. (2017) Long-term prognostic risk after neoadjuvant chemotherapy associated with residual cancer burden and breast cancer subtype. J Clin Oncol 35: 1049–1060.
[11] https://www.sciencedaily.com/releases/2017/08/170807155401.html